退化系统的恢复和重建是人类生存与可持续发展所面临的严峻挑战。我国的生态退化十分严重,已呈现出由结构性破坏向功能性紊乱演变的发展趋势,退化生态系统面积约占国土总面积的1/4。其中,沙化土地占国土总面积的17.93%,因荒漠化造成的直接经济损失约540亿元/年。新中国成立以来,党和国家十分重视沙化土地的治理和沙区生态重建工作。自2000年以来,全国荒漠化和沙化土地面积连续3个监测期保持“双减少”,沙化土地面积由20世纪末年均扩展3 436 km2转变为目前的年均缩减1 980 km2,实现了由“沙进人退”到“人进沙退”的历史性转变。2015年中央出台的《关于加快推进生态文明建设的意见》中明确提出,到2020年我国50%以上可治理的沙化土地要得到有效治理。中科院沙坡头沙漠试验站作为我国最早建立的沙漠研究治理生态站,60余年的长期生态学研究为沙化土地治理和沙区生态重建与恢复提供了重要理论和技术支撑,为中国的防沙治沙作出了贡献。
1 解决了降水小于200 mm的干旱沙漠地区植被建设的关键技术,证实了区域生态恢复的可行性在成功地解决了包兰铁路沿线流动沙丘固定的基础上,对干旱沙漠地区无灌溉人工植被建立的理论范式和技术体系进行了长期的定位研究。明确了以建立覆盖度小于15%的旱生灌木为主的植被恢复体系是草原化荒漠沙区生态系统恢复的最佳模式。发现固沙植被建立初期,旱生灌木和沙障有效地减轻了沙面的强烈风蚀,确保了沙面物理环境的稳定,使大气降尘和养分在沙面沉积,为草本植物的定居和繁衍创造了适宜的生境,隐花植物的拓殖使植被系统更为稳定。原来群落结构单一的植被演变成复杂的多层片结构和多功能群的植被。固定沙丘生物多样性的恢复使原有的人工固沙植被系统演变成与同一气候带相似的、稳定的荒漠生态系统。长期生态学监测研究证实了在我国沙区通过人工植被建设实现区域生态恢复是可行的(图 1),为全球干旱区沙害治理提供了范式[1-5]。

|
| 图 1 沙坡头无灌溉人工植被防护体系说明合理的植被建设促进了区域生态恢复 |
揭示了干旱沙区人工固沙植被在种类组成、结构和功能群等生态系统特征方面对沙地水循环演变的响应机理和演替规律[1, 5];对沙区植被调控水循环和水循环驱动植被演替过程进行了参数化和量化研究(图 2),对植物水分利用计算实现了尺度转换,量化了植被与土壤水分之间的动态关系[6-12];明确了水循环对土壤-植被系统演替的驱动作用,定量确定了水分在土壤-植被系统中的再分配机制,探明了荒漠生态系统地表径流驱动下的水分再分配机理,研究了植物蒸腾特征及其尺度转换,揭示了固沙灌木冠层截留特征,探明了固沙灌木树干液流规律,定量研究了沙区稀释凝结水特征及对环境因子的响应规律,建立了土壤水分随机模型,确定了不同生物气候带植物固沙的生态-水文阈值。基于水分和其他生境因子异质性的长期动态变化,提出了干旱沙区植被恢复的模式[4, 5];回答了干旱沙区植被-土壤系统中水分及生境因子恢复的速率、恢复时间等生态恢复特性的问题[13]。理论上解释了沙地土壤水分有效性浅层化与植被向荒漠化草原演变的格局特征[4],阐明了生态恢复过程生物多样性的繁衍与水循环关系及其适应性对策的生态学机理[1, 4],为干旱沙区通过建立人工植被促进生态恢复提供了理论支撑(图 3)。提出生态修复的关键技术和模式,并在实践中广泛应用推广。包括沙区雨养型植被建设技术与模式、新型飞播植被技术与模式、沙区交通干线“灌木+草本+隐花植物”立体生态恢复技术和植物水分生态位造林技术[3-14]。

|
| 图 2 利用大型称重式Lysimeter研究干旱沙区土壤水循环的植被调控机理 |
|
| 图 3 荒漠生态系统恢复的理论模式 |
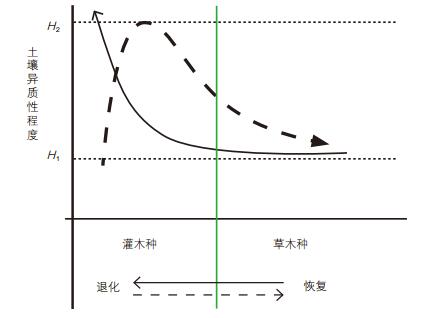
长期监测表明,随着固沙植被区深层土壤的干旱化,灌木种在群落中的优势地位和主导作用也逐渐减弱,并有从植被组成中退出的趋势。此过程因灌木“沃岛效应”的削弱而相应地使土壤资源分布的空间异质性程度减弱。大量固定沙面的隐花植物(藻类、藓类和地衣)的繁衍、一年生植物和多年生草本的定居,使植被朝着以草本为优势的、与邻近草原化荒漠和荒漠化草原类似的原生植被类型演变和恢复。因此,土壤资源分布的异质性程度在植被格局和过程中起着重要的作用,也是驱动干旱区植被退化或恢复的关键因素之一,而土壤生境的恢复则决定着生态恢复效果的可持续性[2, 15, 16]。当土壤资源异质性程度高时,系统发生退化,当异质性降低时,系统开始恢复[15]。
4 探明了生物土壤结皮的生态与水文功能生物土壤结皮(Biological Soil Crust, 以下简称BSC)是由隐花植物如蓝藻、绿藻、地衣、藓类和微生物,以及相关的其他生物体通过菌丝体、假根和分泌物等与表层土壤颗粒“胶结”而形成的,具有独特结构和功能的地表生物覆盖体,是荒漠系统中联结生物与非生物因素的“生态系统工程师”,其盖度达到干旱区地表活体覆盖的40%以上。基于野外长期定位监测,通过控制与模拟实验,率先揭示了温带荒漠BSC的形成和演替规律,提出了大气降尘是其形成物质基础的重要观点,明确了BSC的演替分为蓝藻、地衣和藓类为优势类群的3个阶段(图 4),为甄别干旱区生态退化或恢复提供了新途径,为全球荒漠化防治和风沙区生态重建提供了新思路[1, 5, 17, 18];阐明了BSC对降水入渗、地表蒸发、凝结水捕获和土壤水再分配等水文过程的影响机制[17, 19-21];提出了BSC拓殖驱动了沙区人工植被演替的新观点[17],揭示了BSC对维管植物种子萌发、定居和存活的影响机制[22],认为BSC通过改变土壤水文过程和影响植物的存活驱动了植被的演替,理论解释了我国沙区部分人工植被退化的机理[17];揭示了BSC碳、氮固定的生理生态学机制,提出并实验证明了BSC是温带荒漠生态系统碳、氮来源的重要贡献者的观点,为荒漠系统碳、氮来源提供了新的证据[23-25];实验证明了BSC对土壤动物活动的影响,以及BSC对气候变化与环境干扰的响应,包括UV-B辐射、氮沉降、风沙流和沙埋干扰,以及生态系统管理措施和人为干扰的响应[17, 26]。出版了《荒漠生物土壤结皮生态水文学研究》和《中国沙区生物土壤结皮生态生理学研究》专著2部,引领了国内相关研究[27, 28]。

|
| 图 4 生物土壤结皮演替顺序 (a)腾格里沙漠流动沙丘;(b)以蓝细菌和藻类为优势种的生物土壤结皮;(c)以地衣为优势种的生物土壤结皮;(d)以藓类为优势种的生物土壤结皮 |
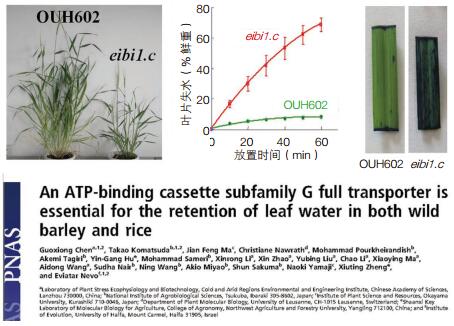
在植物逆境适应的分子机理研究方面,首次在单子叶植物中发现了与植物抗旱密切相关的角质层基因Eibi1,该基因与叶片角质层保水功能密切相关(图 5)。研究了叶片角质层形成机制与角质层保水功能对植物抗旱的贡献[29, 30]。分析了荒漠植物抗逆适应的基因调控机制。通过转录组学发现沙米中有大量耐热基因和丰富的热激蛋白,且高温胁迫能够诱导这些基因的快速高度表达,同时发现沙米具有很好的耐盐性[31]。红砂转录组学研究显示红砂中存在与3种抗旱适应机制(逃旱、避旱和耐旱)相关的大量基因,同时发现次生代谢黄酮类合成代谢途径和C4光合代谢途径参与了干旱适应调控[32]。数字基因表达谱分析了不同胁迫处理后红砂差异表达基因及其变化,发现促分裂原活化蛋白(MAP)激酶级联信号途径和黄酮合成代谢途径相互作用参与对非生物胁迫的调控[33-36]。
|
| 图 5 角质层Eibi1基因与叶片角质层保水功能研究的相关结果发表在PNAS |
在植物逆境适应的生理机制方面,发现荒漠植物在非生物胁迫过程中体内能够累积大量的渗透调节物质,维持细胞膨压并降低细胞内的渗透势,同时具有大量的抗氧化物质来有效清除体内活性氧自由基的伤害。另外,荒漠植物叶片表皮超微形态结构和叶肉内部结构表现出丰富的多样性,表皮附属物(如绒毛、蜡质层等)与旱生结构相互协调, 共同抵御强光以及降低蒸腾和细胞渗透势等来适应干旱和其他不利环境[37]。不同生境下植物还形成不同的适应类型,如不同生态型芦苇从表型到结构都进化出不同的适应机制[38];胡杨叶片在发育过程中形成不同的叶型,成熟的阔叶型具有最强适应能力[39]。荒漠植物还具有强大的代谢调控能力。水分代谢过程中通过增大根部导水率而形成较低的水势,同时通过木质部栓塞而阻断高强度的蒸腾来应对干旱环境[40]。另外,C4代谢途径在荒漠植物中也发挥了重要作用。
6 结语60年来,沙坡头站始终围绕国家生态建设的重大科技需求和国际长期生态学学科发展的需要,在沙害防治和荒漠生态系统恢复与重建等方面取得了一大批公益性的原创性成果,解决了国家在沙漠和沙漠化土地治理中亟需解决的科技问题,为区域经济与社会可持续发展提供了重要的科技支撑。先后获得中科院科技进步奖一等奖、国家科技进步奖特等奖、联合国开发计划署(UNEP)“全球环境500佳”、UNDP“荒漠化防治最佳实践奖”、宁夏回族自治区科技进步奖一等奖、甘肃省自然科学奖一等奖、国家科技进步奖二等奖等多项国家和省部级奖励。自2000年以来,在国际知名刊物发表SCI论文300余篇(含PNAS 3篇),出版专著8部,在国内外产生了重要的影响。我们坚信,沙坡头站的长期生态学研究仍将在我国北方风沙区生态恢复与生态安全的实践中继续发挥理论指导与技术支撑的重要作用。
| [1] | Li X R, Xiao H L, Zhang J G, et al. Long-term ecosystem effects of sand-binding vegetation in the Tengger desert, northern China. Restoration Ecology, 2004, 12(3): 376–390. DOI:10.1111/rec.2004.12.issue-3 |
| [2] | Li X R, Xiao H L, He M Z. Sand barriers of straw checkerboards for habitat restoration in extremely arid desert regions. Ecological Engineering, 2006, 28(2): 149–157. DOI:10.1016/j.ecoleng.2006.05.020 |
| [3] | Li X R, Kong D S, Tan H J, et al. Changes in soil and vegetation following stabilization of dunes in the southeastern fringe of the Tengger desert. Plant and Soil, 2007(300): 221–231. |
| [4] | Li X R, Zhang Z S, Tan H J, et al. Ecological restoration and recovery in the wind-blown sand hazard areas of northern China: relationship between soil water and carrying capacity for vegetation in the Tengger Desert. Science China (Life Sciences), 2014, 57(5): 539–548. DOI:10.1007/s11427-014-4633-2 |
| [5] | Li X R, Zhang Z S, Huang L, et al. Review of the ecohydrological processes and feedback mechanisms controlling sand-binding vegetation systems in sandy desert regions of China. Chinese Science Bulletin, 2013, 58(13): 1483–1496. DOI:10.1007/s11434-012-5662-5 |
| [6] | Huang L, Zhang Z S, Li X R. Sap flow of Artemisia ordosica and the influence of environmental factors in a revegetated desert area: Tengger Desert, China. Hydrological Processes, 2010, 24(10): 1248–1253. |
| [7] | Wang X P, Pan Y X, Zhang Y F, et al. Temporal stability analysis of surface and subsurface soil moisture for a transect in artificial revegetation desert area, China. Journal of Hydrology, 2013(507): 100–109. |
| [8] | Wang X P, Li X R, Zhang J G. Measurement of rainfall interception by xerophytic shrubs in re-vegetated sand dunes. Hydrological Sciences Journal, 2005, 50(5): 897–909. |
| [9] | Zhang Z S, Li X R, Dong X J, et al. Rainfall interception by sand-stabilizing shrubs related to crown structure. Sciences in Cold and Arid Regions, 2009, 1(2): 0107–0119. |
| [10] | Wang X P, Zhang Y F, Hu R, et al. Canopy storage capacity of xerophytic shrubs in Northwestern China. Journal of Hydrology, 2012, 454-455(8): 152–159. |
| [11] | Wang X P, Wang Z N, Berndtsson R, et al. Desert shrub stemflow and its significance in soil moisture replenishment. Hydrology and Earth System Sciences, 2011, 15(2): 561–567. DOI:10.5194/hess-15-561-2011 |
| [12] | Wang X P, Wang Z N, Berndtsson R, et al. Stemflow of desert shrub and its significance in soil moisture replenishment. Hydrology and Earth System Sciences Discussion, 2010(7): 5213–5234. |
| [13] | Li X R, He M Z, Duan Z H, et al. Recorery of topsoil physicochemical properties China. Geomorpholog, 2007, 88(3-4): 254–265. DOI:10.1016/j.geomorph.2006.11.009 |
| [14] | 李新荣, 张志山, 刘玉冰, 等. 中国沙区生态重建与恢复的生态水文学基础. 北京: 科学出版社, 2016. |
| [15] | Li X R. Influence of variation of soil spatial heterogeneity on vegetation restoration. Science China (Series D-Earth Sciences), 2005, 48(11): 2020–2031. DOI:10.1360/04yd0139 |
| [16] | Li X R, Zhou H Y, Wang X P. The effects of sand stabilization and revegetation on cryptogam species diversity and soil fertility in the Tengger desret, Northern China. Plant and Soil, 2003(251): 237–245. |
| [17] | Li X R, Tian F, Jia R L, et al. Do biological soil crusts determine vegetation changes in sandy deserts? Implications for managing artificial vegetation. Hydrology Processes, 2010(24): 3621–3630. |
| [18] | Li X R, He M Z, Zerbe S, et al. Micro-geomorphology determines communitystructure of biological soil crusts at small scales. Earth Surface Process Landforms, 2010, 35(8): 932–940. DOI:10.1002/esp.v35:8 |
| [19] | Pan Y X, Wang X P, Zhang Y F. Dew formation characteristics in a revegetation-stabilized desert ecosystem in Shapotou area, Northern China. Journal of Hydrology, 2010, 387(3-4): 265–272. DOI:10.1016/j.jhydrol.2010.04.016 |
| [20] | Liu L C, Li S Z, Duan Z H. Effects of microbiotic crusts on dew deposition in the restored vegetation area at Shapotou, Northwest China. Journal of Hydrology, 2006, 328(1-2): 331–337. DOI:10.1016/j.jhydrol.2005.12.004 |
| [21] | Li X R, Jia R L, Chen Y W, et al. Association of ant nests with successional stages of biological soil crusts in the Tengger desert, Northern China. Applied Soil Ecology, 2011, 47(1): 59–66. DOI:10.1016/j.apsoil.2010.10.010 |
| [22] | Li X R, Jia X H, Long L Q. Effects of biological soil crusts on seed bank, germination and establishment of two annual plant species in the Tengger Desert (N China). Plant and Soil, 2005, 277(1-2): 375–385. DOI:10.1007/s11104-005-8162-4 |
| [23] | Su Y G, Li X R, Chen Y W, et al. Carbon fixation of cyanobacterial-algal crusts after desert fixation and its implication to soil organic carbon accumulation in desert. Land Degradation Development, 2013, 24(4): 342–349. DOI:10.1002/ldr.v24.4 |
| [24] | Li X R, Zhang P, Su Y G, et al. Carbon fixation by biological soil crusts following revegetation of sand dunes in arid desert regions of China: A four-Year field study. Catena, 2012(97): 119–126. |
| [25] | Li X R, Wang X P, Li T, et al. Microbiotic soil crust and its effect on vegetation and habitat on artificially stabilized desert dunes in Tengger Desert, North China. Biology and Soil Fertility, 2002, 35(3): 147–154. DOI:10.1007/s00374-002-0453-9 |
| [26] | Jia R L, Li X R, Liu L C, et al. Soil Biology and Biochemistry. 2012: 31-39. |
| [27] | 李新荣. 荒漠生物土壤结皮生态-水文学研究. 北京: 高等教育出版社, 2012. |
| [28] | 李新荣, 回嵘, 赵洋. 中国荒漠生物土壤结皮生理生态学研究. 北京: 高等教育出版社, 2016. |
| [29] | Chen G X, Komatsuda T, Ma J F, et al. An ATP-binding cassette subfamily G full transporter is essential for the retention of leaf water in both wild barley and rice. PNAS, 2011, 108(30): 12354–12359. DOI:10.1073/pnas.1108444108 |
| [30] | Li C, Wang A D, Ma X Y, et al. An eceriferum locus, cer-zv, is associated with a defect in cutin responsible for water retention in barley (Hordeum vulgare) leaves. Theoretical Applied Genetics, 2013, 126(3): 637–646. DOI:10.1007/s00122-012-2007-3 |
| [31] | Zhao P, Capella-Gutierrez S, Shi Y, et al. Transcriptomic analysis of a psammophyte food crop, sand rice (Agriophyllum squarrosum) and identification of candidate genes essential for sand dune adaptation. BMC Genomics, 2014(15): 872. |
| [32] | Shi Y, Yan X, Zhao P S, et al. Transcriptomic analysis of a tertiary relict plant, extreme xerophyte Reaumuria Soongorica to identify genes related to drought adaptation. PLoS One, 2013, 8(5): e63993. DOI:10.1371/journal.pone.0063993 |
| [33] | Liu M L, Li X R, Liu Y B, et al. Analysis of differentially expressed genes under UV-B radiation in the desert plant Reaumuria soongorica. Gene, 2015, 574(2): 265–272. DOI:10.1016/j.gene.2015.08.026 |
| [34] | Liu M L, Li X R, Liu Y B, et al. Regulation of flavanone3-hydroxylase gene involved in the flavonoid biosynthesis pathway in response to UV-B radiation and drought stress in the desert plant, Reaumuria soongorica. Plant Physiology and Biochemistry, 2013(73): 161–167. |
| [35] | Liu Y B, Liu M L, Li X R, et al. Identification of differentially expressed genes in leaf of Reaumuria soongorica under PEGInduced drought stress by digital Gene Expression Profiling. PLoS One, 2014(9): e94277. |
| [36] | Liu Y B, Li X R, Tan H J, et al. Molecular characterization of RsMPK2a C1 subgroup mitogen-activated protein kinase in the desert plant Reaumuria soongorica. Plant Physiology and Biochemistry, 2010, 48(10-11): 836–844. DOI:10.1016/j.plaphy.2010.07.001 |
| [37] | Wu Y X, Ding N, Zhao X, et al. Molecular characterization of PeSoS1: the putative Na+/H+ antiporter of populous euphratica. Plant Molecular Biology, 2007(65): 1–11. |
| [38] | Liu Y B, Li X R, Liu M L, et al. Responses of three different ecotypes of reed (Phragmites communis Trin.) to their natural habitats: leaf surface micro-morphology, anatomy, chloroplast ultrastructure and physio-chemical characteristics. Plant Physiology and Biochemistry, 2012, 51: 159–167. DOI:10.1016/j.plaphy.2011.11.002 |
| [39] | Liu Y B, Li X R, Chen G X, et al. Epidermal micromorphology and mesophyll structure of Populus euphratica heteromorphic leaves at different development stages. PLoS One, 2015, 10(9): e0137701. DOI:10.1371/journal.pone.0137701 |
| [40] | Liu Y B, Li X R, Liu M L, et al. Responses of three different ecotypes of reed (Phragmites communis Trin.) to their natural habitats: leaf surface micro-morphology, anatomy, chloroplast ultrastructure and physio-chemical characteristics. Plant Physiology and Biochemistry, 2012(51): 159–167. |


