2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
随着工农业和社会的发展,工农业废水以及生活污水大量排放,水污染事件频发,严重破坏了人类赖以生存的水资源环境,水污染防治工作迫在眉睫。开展水污染监测、及时有效地掌握水质污染的各项指标是水污染防治的重要环节。传统的水污染监测分析方法操作步骤繁琐、测试周期长,分析仪器体积大、价格高,难以满足广域水环境现场实时检测以及分布式组网在线监测的需求。亟待开发小型化、低成本、操作简单、响应快速的水环境监测技术和监测仪器。同时,一些痕量、高毒性、难降解的污染物,如重金属离子和持久性有机污染物等,需要检测方法和检测技术具有超高的灵敏度。
生物传感器利用生物分子之间的特异性识别与反应,通过将生物分子识别元件固定在传感器敏感表面,实现对待测物的特异性识别。生物分子识别元件通常是生物体成分(如酶、抗原、抗体、DNA等)或生物体本身(如细胞、组织等)。生物传感器的换能器进一步将变化的化学或物理信号转换为可测量的电信号,实现对待测物浓度的检测。换能器可以是电化学的、光学的、热学的、压电的或磁学的[1]。生物传感器具有选择性好、灵敏度高的优点。与传统的生物、化学物质检测分析仪器相比,生物传感器具有体积小、设备简单、操作简便、响应快、功耗低、成本低等优势,有利于实现生物、化学物质的现场及快速检测,在医疗健康、食品安全、环境监测等诸多领域具有广阔的应用前景。
按照识别元件分类,生物传感器可以分为酶传感器、免疫传感器、DNA传感器、组织传感器、微生物传感器等。本文面向水环境监测需求,对若干不同类型的生物传感器在水环境监测领域的应用研究进行综述。
1 生物传感器及其水环境监测应用生物传感器多种多样[1]。本节面向水环境监测应用需求,主要调研归纳了酶、免疫、DNA、组织、微生物等生物传感器的研究与发展。
1.1 酶传感器在水环境监测中的应用酶是具有生物活性且能起特异性催化作用的一类蛋白质,具有反应速度快、催化效率高、反应条件温和以及高选择性和高特异性等特点,被广泛用于制备酶生物传感器。酶传感器能对生化物质实现原位、准确、灵敏、快速的检测。在水环境污染监测领域,酶传感器常用于有机磷农药、酚类物质、硝酸盐和重金属离子等的检测。
针对有机磷农药检测的酶传感器,通常利用有机磷农药对乙酰胆碱酯酶活性的抑制作用,通过检测电流实现对有机磷农药的检测。近年来涌现出了许多用于乙酰胆碱酯酶固定的新型材料,如金纳米颗粒[2]、银纳米线[3]等纳米材料,以及微凝胶[4]等聚合物材料。同时也出现了许多新的方法,如基于锥形光纤酶传感器的有机磷检测方法[5]。Wei和Feng[6]研究了一种基于乙酰胆碱酯酶/氮掺杂多孔碳/硼掺杂金刚石电极的电化学生物传感器,氮掺杂多孔碳的孔状结构和良好的生物相容性为乙酰胆碱酯酶的固定提供了大量的反应位点,有效维持了乙酰胆碱酯酶的活性;同时氮的引入提高了电极表面的电导率、加速了电子传递速率。测试结果表明,敌敌畏和杀螟松的检测范围均为0.1-10 000 ng/L,检测限分别低至1.50 pg/L和4.40 pg/L。为了降低酶固定化的难度,充分利用酶的特异性作用,Caballero-Díaz等[7]利用氮掺杂石墨烯量子点和乙酰胆碱酯酶作为生物识别元件,开发了荧光纳米传感器,用于河水中杀虫剂苯氧威的测定。该传感器利用酶的产物对氮掺杂石墨烯量子点荧光的淬灭作用实现检测,传感器无需固定化酶。测试结果表明,研制传感器对苯氧威的检测线性范围为6-70 µmol/L,检出限为3.15 µmol/L,并具有较好的重现性。
酚类物质是水环境中常见的高毒污染物,对酚类物质进行检测具有重要的意义。Sethuraman等[8]基于聚(3, 4-乙烯二氧噻吩)-还原氧化石墨烯-三氧化二铁-多酚氧化酶(PEDOT-rGO-Fe2O3-PPO)复合改性玻碳电极,对邻苯二酚进行了特异性检测。所制备的复合电极酶的负载能力高、电子转移速率快,对邻苯二酚的检测线性范围为4×10-8-6.20×10-5 mol/L,检测下限为7×10-9 mol/L。当储存在约4℃的缓冲液中时,该生物传感器的稳定性可长达75天。
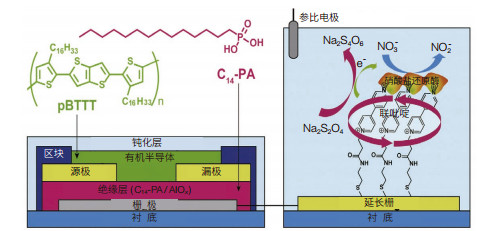
水中过量的硝酸盐会对人体产生危害,硝酸盐的检测在水质监测中也占有重要的地位[9]。Minami等[10]首次报道了一种基于延长栅型的有机场效应晶体管(OFET)酶生物传感器(图 1),对硝酸盐检测的下限低至45 µg/ L,灵敏度可以与一些传统的检测方法相媲美。由于OFET具有可印刷性、机械灵活性、拉伸性和可抛弃等特点,该研究为水中低成本、现场检测的硝酸盐传感器的研制开辟了一条新途径。Ali等[11]基于氧化石墨烯(GO)纳米片和PEDOT纳米纤维(PEDOT-NF)设计了一种微流体阻抗型硝酸盐传感器,其中PEDOT-NFsGO复合物用于固定硝酸还原,研究表明GO和PEDOTNF之间存在协同作用。该传感器在0.44-442 mg/L的硝酸盐离子浓度范围内,灵敏度为61.15 Ω·L·mg-1·cm-2,检测限为0.135 mg/L,并具有良好的特异性、可靠性和重现性。
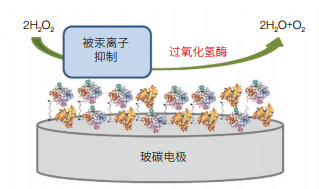
伴随着工业化进程,含有重金属离子(Cu2+、Zn2+、Pb2+、Cd2+、Cr3+、Hg2+等)的污水大量排放,严重危害着水环境及水生生物。利用重金属离子对酶的抑制作用,采用如辣根过氧化酶[12]、乳酸脱氢酶[13]、脲酶[14]、葡萄糖氧化酶[15]等可以研制用于重金属检测的酶传感器。水环境中痕量汞离子的原位、准确、快速和灵敏检测是人们尤为关注的问题。Elsebai等[16]以戊二醛和牛血清白蛋白为交联剂,将过氧化氢酶固定在玻碳电极表面,研制用于汞离子检测的酶传感器(图 2),实现了对痕量汞离子的检测,检测限为1.8×10-11 mol/L,检测线性范围5×10-11-5×10-10mol/L。将该传感器应用于不同类型水样中汞离子的测定,结果表明该传感器对汞离子有很好的选择性。
1.2 免疫传感器在水环境监测中的应用免疫传感器是基于抗原抗体之间的特异性亲和反应而实现检测的一类生物传感器。基于抗体的免疫分析技术,因具有操作简便、携带方便、成本低廉、反应迅速等特点而用于环境监测传感器的研制,目前多应用于农药以及重金属离子等污染物的检测[17-19]。
Guo等[20]基于抗三唑磷的单克隆抗体设计了SPR生物传感器,该传感器对于杀虫剂三唑磷具有较好的特异性和较低的检测下限(0.096 ng/mL),线性检测范围为0.98-8.29 ng/mL,该传感器芯片可重复使用160次。Belkhamssa等[21]将莠去津抗体修饰在多壁碳纳米管场效应管上,基于免疫反应实现对有机农药莠去津的检测,其检测下限为0.001 ng/mL,线性检测范围为0.001-10 ng/mL。Monerris等[22]通过在玻碳电极表面固定抗雌激素酮的单克隆抗体,制备电化学免疫传感器用于测定水样中的痕量雌激素酮。
在重金属离子检测中,抗体通常与EDTA螯合的金属离子结合来实现特异性识别[19]。Shu等[23]利用小鼠抗Cu2+-EDTA单克隆抗体来捕获Cu2+-EDTA螯合物,然后利用紫外线辐射降解免疫复合物以释放游离的Cu2+,基于Cu2+对CdSe/ZnS量子点的荧光猝灭效应,实现对于Cu2+的高特异性和高灵敏度检测。该免疫传感器的检测下限为0.33 ng/mL。由于采用抗体捕获Cu2+,避免了其他重金属离子对量子点荧光淬灭效应的干扰,提高了传感器的选择性。López等[24]基于抗Cd2+-EDTA单克隆抗体对Cd2+免疫传感器进行了设计,该传感器具有较宽的检测范围0.4-2 000 μg/L,检测下限为0.1 μg/L。
Xing等[25]基于免疫层析技术研制了能够实现水中重金属、藻毒素、抗生素、激素和杀虫剂等5种污染物同时检测的纸基免疫传感器。以铅(Ⅱ)、微囊藻毒素-亮氨酸-精氨酸(MC-LR)、氯霉素(CAP)、睾酮(T)和百菌清(CTN)作为代表物,5种不同的抗原被分别固定在硝化纤维素膜上,样本中的待测物和固定的抗原竞争结合单克隆金标抗体,5种物质的检测下限分别为4 ng/mL、1 ng/mL、0.1 ng/mL、5 ng/mL和5 ng/mL,检测时间20分钟。该纸基传感器为水中污染物的现场半定量检测提供了一种有效的方法。
1.3 DNA传感器在水环境监测中的应用DNA具有与抗原抗体结合类似的高亲和力,并具有高灵敏度、高选择性、高稳定性、低毒性,以及易于合成和修饰等特点,成为生物和化学物质检测中的常用识别元件。目前,DNA常被用来检测水中的重金属离子以及农药、抗生素等有机污染物。
利用Hg2+引起富含胸腺嘧啶(T)的DNA单链折叠,形成T-Hg2+-T特异性结构,抑制DNA杂交反应的性质,能够研制用于Hg2+检测的DNA传感器。Jia等[26]研制了局域等离子体共振(LSPR)光纤DNA传感器用于水中Hg2+的检测。该传感器以DNA杂交双链为联接,构建纳米金颗粒Core-satellites结构并激发等离子体耦合增强效应;通过检测Hg2+抑制DNA杂交反应过程中,对等离子体耦合强度以及LSPR谐振波长的影响,实现对Hg2+的检测,检测线性范围5-150 nmol/L,检测下限为3.4 nmol/L。
Zuo等[27]提出一种基于WS2纳米片的双色荧光生物传感器,用于检测Hg2+和Ag+。该传感器利用WS2纳米片的荧光猝灭能力和WS2纳米片与DNA分子之间的相互作用而实现检测。通过监测525 nm和583 nm处的荧光强度的变化,可以实现对Hg2+和Ag+的同时检测。Hg2+和Ag+的线性检测范围分别为6.0-650.0 nmol/L和5.0-1 000.0 nmol/L,检测下限分别为3.3 nmol/L和1.2 nmol/L。
利用核酸切割酶识别特定DNA双链并切割其中某条单链的性质,以及重金属能够激活核酸酶水解产生并释放出单链,游离出的单链又能够与其他的分子信标重新杂交,触发下一轮酶切引起信号的循环放大的性质,能够实现对重金属离子的检测。赵永席等[28]研制了基于核酸切割酶与脱氧核酶的荧光循环放大系统,实现Pb2+的检测,检测下限0.1 nmol/L,并具有好的选择性。Hong等[29]基于这一原理研制了电化学生物传感器,对Hg2+的线性范围10-50 000 pmol/L,检测下限低至1.6 pmol/L。
Arvand和Mirroshandel等[30]基于石墨烯/适配体-量子点(GO/aptamer-QDs)复合物设计了一种能够检测克瘟散杀菌剂(EDI)的荧光增强型适配体传感器。该传感器利用从量子点到石墨烯片的荧光共振能量转移效应致使量子点荧光淬灭的性质,以及EDI对GO的取代作用,实现对EDI的荧光增强型检测。该传感器的线性检测范围为5×10-4-6×10-3 mg/L,检出限为1.3×10-4 mg/L,重现性(RSD=3.9%,n=10)良好,对其他化学结构相似的农药具有很好的选择性。Zourob等[31]筛选出高亲和力、特异性强的多菌灵DNA适配体,并采用自组装单层膜法将DNA适配体修饰在金电极表面,实现对多菌灵的特异性检测,检测范围10-10 000 ng/L,检测限8.2 ng/L,而其他常用农药如异丙隆、阿特拉津、利谷隆、氟乐灵、西维因和甲基对硫磷等不会对该传感器的检测造成干扰。
1.4 组织传感器在水环境监测中的应用近些年来,动植物组织也被作为生物传感器的识别元件来进行相应的识别检测[17],尤其是水生植物已经成为环境研究的重要研究工具。研究人员可以通过控制外部环境条件(例如光、热或者除草剂、重金属及有机污染物等),对植物的生命活动进行检测,从而对环境条件进行评估[32]。
以藻类为例,Tsopela等[33]基于藻类设计了一种由电化学三电极微流控平台组成的便携式除草剂现场检测装置。利用敌草隆除草剂的存在会引起藻类光合作用的代谢活动发生紊乱,从而导致其产氧速率受到影响的特点,实现对除草剂的检测。
Harguinteguy等[34]利用狐尾藻对河流中的重金属离子浓度进行连续4个月的监测,发现狐尾藻植物体可以实现对重金属离子的积累,从而提出利用该种水生植物能实现重金属水体污染的早期监测的方案;同时该课题组发现小眼子菜也可以用于重金属离子的监测[35]。
Védrine等[36]利用小球藻设计了一种用于水中污染物检测的光学生物传感器。他们将小球藻微藻包裹在石英微纤维过滤器表面,通过研究除草剂对于叶绿素荧光的影响,检测水体中甲酚、阿特拉津、西玛津、异丙隆和敌草隆等5种农药的浓度。结果表明该方法能够实现>1 μg/mL浓度下的检测,5种农药的检测下限分别为5 μg/L、0.255 μg/L、0.5 μg/L、0.025 μg/L和0.025 μg/L。
Merkoçi等[37]以铋作为前驱体,利用组织与铋的结合作用,在电化学沉积铋的过程中将蘑菇组织固定到修饰有多壁碳纳米管的丝网印刷电极表面,得到一种苯酚传感器。该传感器的线性响应范围为2-200 μmol/L,检测限为1.17 μmol/L。
1.5 微生物传感器在水环境监测中的应用微生物传感器以微生物为识别元件,利用其在待测物下的代谢过程实现对待测物的检测。微生物可以是单一菌种、菌群或者死细胞。
结合微生物实现水中生化需氧量(BOD)的检测,是微生物传感器在水环境监测领域的一个重要的应用方向。生活污水与工业废水中含有的大量有机污染物,可经好气菌的生物化学作用而分解,并消耗大量的溶解氧,破坏水体中氧的平衡,造成鱼类及其他水生生物的缺氧死亡。由于水体中所含的有机物成分复杂,通常利用水中有机物在一定条件下所消耗的氧来间接表示水体中有机物的含量。BOD能相对表示出可被微生物分解的有机污染物含量,符合水体自净化的实际情况,因而在水质评价方面更具有实际意义。国内外采用的BOD检测方法主要包括五天培养法、测压法[38]、活性污泥曝气降解法[39]、检压库仑法[40]和较高温度法[38]等,但这些方法存在测定周期长、操作复杂、不适用于现场监控、无法及时反映水质情况等缺点。
1977年,Karube等[41]首次将土壤中的微生物修饰在电极上测量污水中的BOD,实现了BOD的在线快速检测。微生物BOD传感器通常由微生物菌膜和氧电极构成,利用溶解氧电极直接检测微生物在生物降解有机物时引起氧浓度的变化,并具有简单、易于微型化、集成化和方便使用等优点。此后,利用微生物检测生化需氧量的文章被大量报道。
中科院武汉病毒所环境微生物室是我国最早从事BOD微生物传感器研究的机构,张先恩等[42]于1986年筛选获得了具有广泛代谢谱和降解能力的假单胞菌作为BOD微生物传感器的工作菌株,可在15分钟内完成一个样品BOD的测定,并适合于有毒工业污水中BOD的测定。该团队1987年研制的智能化BOD仪器,可在石油化工废水处理厂等现场应用,该项目1989年获中科院科技进步奖三等奖,从而对BOD微生物传感器的研究开发起到了重要的推动作用。
中科院长春应化所董绍俊团队在BOD微生物传感器的基础研究和应用研究方面均有重要贡献,2003年以来该团队发表了20余篇BOD微生物传感器相关的论文,在此基础上开发了BOD测定仪,在长春市环境监测中心站等地现场应用。BOD微生物传感器的研究涉及用于微生物固定的材料和方法,如溶胶-凝胶材料[43]、有机无机杂化材料[44]、纳米管[45]和石墨烯[46]等材料,同时也涉及快速检测方法与传感器[47]以及在线监测系统[48, 49]等。实现微生物的有效固定,提高BOD传感器的稳定性和寿命,同时缩短检测的时间,实现BOD的快速检测和在线监测是研究者关注的方向。
Wang等[50]采用固定微生物细胞(IMC)珠作为识别元件测量BOD,其与传统BOD检测的生物敏感膜相比有效减小了传质阻力,提高了灵敏度和稳定性。IMC珠在每天8次检测频率下可保持约70天的生物活性,可实现BOD快速测量。Liu等[49]以铁氰化钾作为媒介,以碳纤维毡作为微生物固定化材料,构建BOD流动检测系统。该系统能在30分钟内检测BOD,稳定性达2个月。Hooi等[51]利用海藻酸钙固定微生物在超微电极上研制BOD检测微生物传感器。该传感器利用超微电极扩散传质快的特点,有效缩短了响应时间,实现了对BOD的快速检测。Kashem等[52]通过将酵母植入被聚乙烯-聚丙烯(PE-PP)包裹的氧敏感膜结构,构建了光学BOD生物传感器。PE-PP膜能够消除环境样品的干扰,并具有试剂用量少,测试时间短(5分钟)的优点。Wang等[53]基于磁性修饰微生物的技术制备无膜式BOD微生物传感器(图 3)。研究以枯草芽孢杆菌为代谢有机物的微生物,将四氧化三铁纳米颗粒(带正电)吸附在枯草芽孢杆菌(带负电)表面形成磁性微生物。利用超微电极阵列和纳米钯/还原羧基石墨烯修饰的超微电极阵列为换能器,在超微电极阵列底部设计一个磁性基底,通过磁场将磁性微生物固定在超微电极阵列表面作为敏感膜,并能通过调控外部磁场实现敏感膜的更新。该传感器具有制备简单、易更新等特点,有利于实现BOD的现场快速检测。
水环境监测传感器的检测对象及检测环境复杂。发展用于现场、实时、在线检测的水质生物传感器面临诸多科学问题和技术难点,重点需要解决传感器的灵敏度、选择性、稳定性,以及器件和系统的微小型化、低功耗、长期自治工作等关键问题。笔者在即将出版的著作中对相关问题作了一些具体分析①,这里重点阐述3个方面的关键技术。
① 夏善红, 周宜开, 等.生物化学微传感器系统及应用.北京:科学出版社, 待出版
2.1 基于生物材料的富集技术对于某些毒性大、标准限值较低的污染物,直接检测难度较大,可以采用预富集的方法,实现痕量检测。常见的液相富集方法包括萃取法[54]、吸附法[55]、离子交换法[56]、膜分离法[57]和生物化学法[58]等,这些方法普遍存在设备试剂昂贵、环境不够友好等问题[59]。近年来,随着生物学以及生物学表征、研究方法的快速发展,以微生物吸附富集为代表的生物化学富集方法受到了广泛关注。利用生物材料与金属离子之间的络合、离子交换以及物理吸附等作用,可以将生物材料作为一种吸附富集材料用于传感器中[60-63],例如Fiol等[64]将育亨树茎和葡萄茎混合于PVC膜中作为生物吸附材料预富集Hg2+。
2.2 生物传感器的微型化随着微纳加工技术和纳米科学技术的发展,以及面向水环境监测无线传感网络构建的需求,水质监测传感器的微型化和小型化成为发展趋势。微纳加工技术能够促进传感器的微型化和批量制造,有助于提升传感器的一致性;而纳米技术能够在传感芯片微型化的同时有效保障以及提升传感器的灵敏度、选择性等性能。
生物传感器的微型化具有以下优点[65-67]:(1)减少价格昂贵的生物功能性材料的消耗,有效降低研发成本;(2)能实现微量分析,检测过程中所需配套试剂量减少,检测过程产生的废液量也随之减少;(3)便于系统集成,有利于形成可用于水环境无线传感网络监测的生物传感器系统。然而生物传感器在微型化过程中仍然存在着诸多技术难题,包括敏感元件的集成、生物材料的固定和保持活性、待测水样的预处理等问题。
2.3 生物敏感材料的可更新固定化方法制备生物敏感膜所选用生物功能性材料的种类、数量、固定化方法以及代谢活性对于传感器的性能具有重要影响。性能优异的生物传感器既要求将生物敏感材料限制在一定的空间且不流失,又要求保持生物的固有活性。现有生物传感器中的生物敏感材料固定技术包括包埋法、吸附法、交联法等,上述方法均在一定程度上存在降低活性、造成交联负效应及敏感膜不易更新等问题。
近年来出现了一些关于生物敏感材料可更新固定化方法的研究。笔者团队研究了磁性功能化细胞技术用于生物传感器的构建[53]。磁性功能化的细胞可以富集在磁铁沟道的周围,通过对磁铁沟道区域的设计实现细胞固定区域的图形化,实现细胞在敏感表面的固定数量和质量的提高。而当磁铁移除后,通过适当的冲洗操作后可以进行重新固定,有效地保障了敏感膜的活性,开辟了可更新传感器敏感膜的新方法。酵母菌和海藻等都可被四氧化三铁纳米颗粒磁性功能化,基于多中心的吸附作用,聚合物修饰的纳米颗粒(带正电)吸附在生物体(带负电)表面,然后再将磁化酵母菌或海藻细胞固定于传感界面上形成敏感膜,整个过程耗时短,比传统方法省时、高效[68]。
3 结语面向水环境监测的生物传感器研究正在不断拓展和深入,具有很好的发展和应用前景。目前,由于生物功能材料的活性尚存在稳定性、一致性等问题,大部分生物传感器还难以适应长期在线监测的应用需求,有待于原理、方法和技术上的进一步研究与突破。
期待生物传感器结合微纳米技术、微流控技术等新兴技术有更大的创新发展,以实现体积小、响应迅速、灵敏度高、抗干扰性强、使用寿命长的水环境监测生物传感器。这将对水环境和水资源的监测和保护具有重要的意义。
| [1] |
张先恩. 生物传感器[M]. 北京: 化学工业出版社, 2006.
|
| [2] |
Hondred J A, Breger J C, Garland N T, et al. Enhanced enzymatic activity from phosphotriesterase trimer gold nanoparticle bioconjugates for pesticide detection[J]. Analyst, 2017, 142(17): 3261-3271. DOI:10.1039/C6AN02575G |
| [3] |
Turan J, Kesik M, Soylemez S, et al. An effective surface design based on a conjugated polymer and silver nanowires for the detection of paraoxon in tap water and milk[J]. Sensors & Actuators B Chemical, 2016, 228: 278-286. |
| [4] |
Sigolaeva L V, Gladyr S Y, Mergel O, et al. Easy-preparable butyrylcholinesterase/microgel construct for facilitated organophosphate biosensing[J]. Analytical Chemistry, 2017, 89(11): 6091-6098. DOI:10.1021/acs.analchem.7b00732 |
| [5] |
Arjmand M, Saghafifar H, Alijanianzadeh M, et al. A sensitive tapered-fiber optical biosensor for the label-free detection of organophosphate pesticides[J]. Sensors and Actuators B:Chemical, 2017, 249: 523-532. DOI:10.1016/j.snb.2017.04.121 |
| [6] |
Wei M, Feng S. Amperometric determination of organophosphate pesticides using a acetylcholinesterase based biosensor made from nitrogen-doped porous carbon deposited on a boron-doped diamond electrode[J]. Microchimica Acta, 2017, 184(9): 3461-3468. DOI:10.1007/s00604-017-2380-3 |
| [7] |
Caballero-Díaz E, Benítez-Martínez S, Valcárcel M. Rapid and simple nanosensor by combination of graphene quantum dots and enzymatic inhibition mechanisms[J]. Sensors and Actuators B:Chemical, 2017, 240: 90-99. DOI:10.1016/j.snb.2016.08.153 |
| [8] |
Sethuraman V, Muthuraja P, Raj A J, et al. A highly sensitive electrochemical biosensor for catechol using conducting polymer reduced graphene oxide-metal oxide enzyme modified electrode[J]. Biosensors & Bioelectronics, 2016, 84: 112-119. |
| [9] |
Sohail M, Adeloju S B. Nitrate biosensors and biological methods for nitrate determination[J]. Talanta, 2016, 153: 83-98. DOI:10.1016/j.talanta.2016.03.002 |
| [10] |
Minami T, Sasaki Y, Minamiki T, et al. Selective nitrate detection by an enzymatic sensor based on an extended-gate type organic fieldeffect transistor[J]. Biosensors & Bioelectronics, 2016, 81: 87-91. |
| [11] |
Ali M A, Jiang H, Mahal N K, et al. Microfluidic impedimetric sensor for soil nitrate detection using graphene oxide and conductive nanofibers enabled sensing interface[J]. Sensors and Actuators B:Chemical, 2017, 239: 1289-1299. DOI:10.1016/j.snb.2016.09.101 |
| [12] |
Moyo M, Okonkwo J O, Agyei N M. An amperometric biosensor based on horseradish peroxidase immobilized onto maize tasselmulti-walled carbon nanotubes modified glassy carbon electrode for determination of heavy metal ions in aqueous solution[J]. Enzyme & Microbial Technology, 2014, 56(7490): 28-34. |
| [13] |
Tan I, Erhan E, Karagöz P, et al. Determination of mercury and nickel by amperometric biosensor prepared with thermostable lactate dehydrogenase[J]. Transactions of Nonferrous Metals Society of China, 2011, 21(10): 2332-2338. DOI:10.1016/S1003-6326(11)61017-0 |
| [14] |
Kuralay F, Yildiz O A. Inhibitive determination of Hg2+ ion by an amperometric urea biosensor using poly(vinylferrocenium) film[J]. Enzyme & Microbial Technology, 2007, 40(5): 1156-1159. |
| [15] |
Liu J, Xu X, Tang L, et al. Determination of trace mercury in compost extract by inhibition based glucose oxidase biosensor[J]. Transactions of Nonferrous Metals Society of China (English Edition), 2009, 19(1): 235-240. DOI:10.1016/S1003-6326(08)60258-7 |
| [16] |
Elsebai B, Ghica M E, Abbas M N, et al. Catalase based hydrogen peroxide biosensor for mercury determination by inhibition measurements[J]. Journal of Hazardous Materials, 2017, 340: 344-350. DOI:10.1016/j.jhazmat.2017.07.021 |
| [17] |
Baeumner A J. Biosensors for environmental pollutants and food contaminants[J]. Analytical & Bioanalytical Chemistry, 2003, 377(3): 434-445. |
| [18] |
Churchill R, Sheedy C, Yau K, et al. Evolution of antibodies for environmental monitoring:from mice to plants[J]. Analytica Chimica Acta, 2002, 468(2): 185-197. DOI:10.1016/S0003-2670(02)00093-4 |
| [19] |
Mehta J, Bhardwaj S K, Bhardwaj N, et al. Progress in the biosensing techniques for trace-level heavy metals[J]. Biotechnology Advances, 2016, 34(1): 47-60. DOI:10.1016/j.biotechadv.2015.12.001 |
| [20] |
Guo Y, Liu R, Liu Y, et al. A non-competitive surface plasmon resonance immunosensor for rapid detection of triazophos residue in environmental and agricultural samples[J]. Science of the Total Environment, 2017, 613-614: 783. |
| [21] |
Belkhamssa N, Justino C I L, Santos P S M, et al. , Label-free disposable immunosensor for detection of atrazine[J]. Talanta, 2016, 146: 430. DOI:10.1016/j.talanta.2015.09.015 |
| [22] |
Monerris M J, Eramo F D, Arévalo F J, et al. Electrochemical immunosensor based on gold nanoparticles deposited on a conductive polymer to determine estrone in water samples[J]. Microchemical Journal, 2016, 129: 71-77. DOI:10.1016/j.microc.2016.06.001 |
| [23] |
Shu Q, Liu M, Ouyang H, et al. Label-free fluorescent immunoassay for Cu2+ ion detection based on UV degradation of immunocomplex and metal ion chelates[J]. Nanoscale, 2017, 228(34): 425. |
| [24] |
López A M, Pons J, Blake D A, et al. High sensitive goldnanoparticle based lateral flow Immunodevice for Cd2+ detection in drinking waters[J]. Biosensors & Bioelectronics, 2013, 47(28): 190-198. |
| [25] |
Xing C, Liu L, Song S, et al. Ultrasensitive immunochromatographic assay for the simultaneous detection of five chemicals in drinking water[J]. Biosensors & Bioelectronics, 2015, 66: 445-453. |
| [26] |
Jia S, Bian C, Tong J H, et al. Fiber-optic sensor based on plasmon coupling effects in gold nanoparticles core-satellites nanostructure for determination of mercury ions (Ⅱ)[J]. Chinese Journal of Analytical Chemistry, 2017, 45(6): 785-790. DOI:10.1016/S1872-2040(17)61017-X |
| [27] |
Zuo X, Zhang H, Zhu Q, et al. A dual-color fluorescent biosensing platform based on WS2 nanosheet for detection of Hg2+ and Ag+[J]. Biosensors & Bioelectronics, 2016, 85: 464-470. |
| [28] |
赵永席, 齐林, 杨卫军, 等. 基于核酸切割酶与脱氧核酶的荧光循环放大系统检测铅(Ⅱ)[J]. 分析化学, 2012, 40(8): 1236-1240. |
| [29] |
Hong M, Wang M, Wang J, et al. Ultrasensitive and selective electrochemical biosensor for detection of mercury (Ⅱ) ions by nicking endonuclease-assisted target recycling and hybridization chain reaction signal amplification[J]. Biosensors & Bioelectronics, 2017, 94: 19-23. |
| [30] |
Arvand M, Mirroshandel A A. Highly-sensitive aptasensor based on fluorescence resonance energy transfer between l-cysteine capped ZnS quantum dots and graphene oxide sheets for the determination of edifenphos fungicide[J]. Biosensors & Bioelectronics, 2017, 96: 324-331. |
| [31] |
Zourob M M, Eissa S H H. Selection and characterization of DNA aptamers for electrochemical biosensing of carbendazim[J]. Analytical Chemistry, 2017, 89(5): 3138-3145. DOI:10.1021/acs.analchem.6b04914 |
| [32] |
Ferrat L, Pergent-Martini C, Roméo M. Assessment of the use of biomarkers in aquatic plants for the evaluation of environmental quality:application to seagrasses[J]. Aquatic Toxicology, 2003, 65(2): 187-204. DOI:10.1016/S0166-445X(03)00133-4 |
| [33] |
Tsopela A, Laborde A, Salvagnac L, et al. Development of a labon-chip electrochemical biosensor for water quality analysis based on microalgal photosynthesis[J]. Biosensors & Bioelectronics, 2016, 79: 568-573. |
| [34] |
Harguinteguy C A, Schreiber R, Pignata M L. Myriophyllum aquaticum as a biomonitor of water heavy metal input related to agricultural activities in the Xanaes River (Córdoba, Argentina)[J]. Ecological Indicators, 2013, 27: 8-16. DOI:10.1016/j.ecolind.2012.11.018 |
| [35] |
Eissa S, Zourob M. Selection and characterization of DNA aptamers for electrochemical biosensing of carbendazim[J]. Analytical Chemistry, 2017, 89(5): 3138-3145. DOI:10.1021/acs.analchem.6b04914 |
| [36] |
Védrine C, Leclerc J C, Durrieu C, et al. Optical whole-cell biosensor using Chlorella vulgaris designed for monitoring herbicides[J]. Biosensors & Bioelectronics, 2003, 18(4): 457-463. |
| [37] |
Merkoçi A, Anik U, Çevik S, et al. Bismuth film combined with screen-printed electrode as biosensing platform for phenol detection[J]. Electroanalysis, 2010, 22(13): 1429-1436. DOI:10.1002/elan.200970002 |
| [38] |
崔建升, 张静, 魏复盛. 生化需氧量(BOD)测定技术进展[J]. 中国环境监测, 2006, 22(3): 85-87. |
| [39] |
李国刚, 王德龙. 生化需氧量测定方法综述[J]. 中国环境监测, 2004, 20(2): 54-57. |
| [40] |
李华玲, 杜秀月, 冉敬文, 等. 生化需氧量(BOD)测定方法进展[J]. 盐湖研究, 2005, 13(3): 62-66. |
| [41] |
Karube I, Matsunaga T, Mitsuda S, et al. Microbial electrode BOD sensors[J]. Biotechnology & Bioengineering, 1977, 102(3): 1535-1547. |
| [42] |
张先恩, 王志通, 简浩然. BOD微生物传感器的研究[J]. 环境科学学报, 1986, 6(2): 184-192. |
| [43] |
Jia J, Tang M, Chen X, et al. Co-immobilized microbial biosensor for BOD estimation based on sol-gel derived composite material[J]. Biosensors & Bioelectronics, 2003, 18(8): 1023-1029. |
| [44] |
Liu L, Shang L, Guo S, et al. Organic-inorganic hybrid material for the cells immobilization:Long-term viability mechanism and application in BOD sensors[J]. Biosensors & Bioelectronics, 2009, 25(2): 523-526. |
| [45] |
Liu L, Zhang S, Xing L, et al. A co-immobilized mediator and microorganism mediated method combined pretreatment by TiO2 nanotubes used for BOD measurement[J]. Talanta, 2012, 93: 314-319. DOI:10.1016/j.talanta.2012.02.039 |
| [46] |
Liu L, Zhai J, Zhu C, et al. One-pot synthesis of 3-dimensional reduced graphene oxide-based hydrogel as support for microbe immobilization and BOD biosensor preparation[J]. Biosensors & Bioelectronics, 2015, 63: 483-489. |
| [47] |
Liu C, Ma C, Yu D, et al. Immobilized multi-species based biosensor for rapid biochemical oxygen demand measurement[J]. Biosensors & Bioelectronics, 2011, 26(5): 2074-2079. |
| [48] |
Liu C, Zhao H, Zhong L, et al. A biofilm reactor-based approach for rapid on-line determination of biodegradable organic pollutants[J]. Biosensors & Bioelectronics, 2012, 34(1): 77-82. |
| [49] |
Liu L, Bai L, Yu D, et al. Biochemical oxygen demand measurement by mediator method in flow system[J]. Talanta, 2015, 138: 36-39. DOI:10.1016/j.talanta.2015.02.001 |
| [50] |
Wang J, Zhang Y, Wang Y, et al. An innovative reactortype biosensor for BOD rapid measurement[J]. Biosensors & Bioelectronics, 2010, 25(7): 1705-1709. |
| [51] |
Hooi K B, Ismaild A K, Ahamad R, et al. A redox mediated UME biosensor using immobilized Chromobacterium violaceum strain R1 for rapid biochemical oxygen demand measurement[J]. Electrochimica Acta, 2015, 176: 777-783. DOI:10.1016/j.electacta.2015.07.089 |
| [52] |
Kashem M A, Suzuki M, Kimoto K, et al. An optical biochemical oxygen demand biosensor chip for environmental monitoring[J]. Sensors and Actuators B:Chemical, 2015, 221: 1594-1600. DOI:10.1016/j.snb.2015.07.119 |
| [53] |
Wang J, Li Y, Bian C, et al. Ultramicroelectrode array modified with magnetically labeled Bacillus subtilis, palladium nanoparticles and reduced carboxy graphene for amperometric determination of biochemical oxygen demand[J]. Microchimica Acta, 2017, 184(3): 763-771. DOI:10.1007/s00604-016-2055-5 |
| [54] |
Martinis E M, Escudero L B, Salvarezza R, et al. Liquid-liquid microextraction based on a dispersion of Pd nanoparticles combined with ETAAS for sensitive Hg determination in water samples[J]. Talanta, 2013, 108(8): 46-52. |
| [55] |
Gao R, Hu Z, Chang X J, et al. Chemically modified activated carbon with 1-acylthiosemicarbazide for selective solid-phase extraction and preconcentration of trace Cu(Ⅱ), Hg(Ⅱ) and Pb(Ⅱ) from water samples[J]. Journal of Hazardous Materials, 2009, 172(1): 324-329. DOI:10.1016/j.jhazmat.2009.07.014 |
| [56] |
Neagu V, Luca C, Ştefan S, et al. Unconventional ion exchange resins and their retention properties for Hg2+ ions[J]. Reactive & Functional Polymers, 2007, 67(12): 1433-1439. |
| [57] |
Kamyabi M A, Aghaei A. A simple and selective approach for determination of trace Hg(Ⅱ) usingelectromembrane extraction followed by graphite furnace atomicabsorption spectrometry[J]. Spectrochimica Acta Part B, 2017, 128: 17-21. DOI:10.1016/j.sab.2016.12.007 |
| [58] |
赵佳, 郭玉高, 孙帅帅, 等. 水体痕量重金属离子富集方法研究进展[J]. 天津化工, 2015, 29(1): 15-18. |
| [59] |
Vijayaraghavan K, Yun Y S. Bacterial biosorbents and biosorption[J]. Biotechnology Advances, 2008, 26: 266-291. DOI:10.1016/j.biotechadv.2008.02.002 |
| [60] |
Alpat S K, Alpat S, Kutlu B, et al. Development of biosorptionbased algal biosensor for Cu(Ⅱ) using Tetraselmis chuii[J]. Sensors and Actuators B:Chemical, 2008, 128(1): 273-278. |
| [61] |
Alpat S, Alpat S K, Çadırcı B H, et al. A novel microbial biosensor based on C ircinella, sp. modified carbon paste electrode and its voltammetric application[J]. Sensors and Actuators B:Chemical, 2008, 134(1): 175-181. DOI:10.1016/j.snb.2008.04.044 |
| [62] |
Yao H, Ramelow G J. Biomass-modified carbon paste electrodes for monitoring dissolved metal ions[J]. Talanta, 1998, 45(6): 1139-1146. DOI:10.1016/S0039-9140(97)00239-7 |
| [63] |
Ouangpipat W, Lelasattarathkul T, Dongduen C, et al. Bioaccumulation and determination of lead using treatedPennisetum-modified carbon paste electrode[J]. Talanta, 2003, 61(4): 455-464. DOI:10.1016/S0039-9140(03)00316-3 |
| [64] |
Fiol N, Torre F D L, Demeyere P, et al. Vegetable waste-based sensors for metal ion determination[J]. Sensors and Actuators B:Chemical, 2007, 122(1): 187-194. DOI:10.1016/j.snb.2006.05.038 |
| [65] |
田承云, 张国雄. 微型电流式生物传感器[J]. 化学传感器, 1993, 13(1): 16-27. |
| [66] |
Rodrigues N P, Kimura H, Sakai Y, et al. Cell-based microfluidic biochip for electrochemical real-time monitoring of glucose and oxygen[J]. Sensors and Actuators B:Chemical, 2008, 132(2): 608-613. DOI:10.1016/j.snb.2007.12.025 |
| [67] |
Cortés-Salazar F, Beggah S, Meer J R V D M, et al. Electrochemical As(Ⅲ) whole-cell based biochip sensor[J]. Biosensors & Bioelectronics, 2013, 47: 237-242. |
| [68] |
Fakhrullin R F, García-Alonso J, Paunov V N. A direct technique for preparation of magnetically functionalised living yeast cells[J]. Soft Matter, 2010, 6(2): 391-397. DOI:10.1039/B914065D |