细胞是生命的基本结构和功能单元。生物的生长、发育、繁殖与进化等一切生命活动都以细胞为基础。多细胞生物包含多种形态与功能各异的细胞,所有这些细胞都是由单个受精卵增殖分化而来。细胞一旦产生就面临着分裂、增殖、运动、分化和死亡等各种不同的细胞命运,研究和揭示细胞生命本质及活动规律是生命科学永恒的主题。
从受精卵到生物个体发育过程中,细胞时刻都面临选择:保持现有的身份和状态还是转变成另一种身份和状态。细胞身份和状态的维持和变化既受细胞自身内在遗传因素的控制,也受细胞周围环境因素的调节。细胞内外因素的相互作用使得细胞的命运具有可变和转换的特征。为什么受精卵可以产生所有类型的细胞?为什么在生命个体发育过程中细胞的形态和功能会发生转变?为什么某种组织的细胞(如神经细胞、肌肉细胞)一旦形成就会稳定维持它的特性,而有些却具有可变性?为什么面对环境的胁迫,细胞能够维持自身的稳态?为什么有机体的正常细胞可以转变为不正常的癌细胞或其他病变细胞?这些关于细胞命运可塑性的待解之谜是当代生命科学基础研究的前沿热点。
对于当前国际前沿发展态势的分析显示,有关“细胞命运可塑性”的研究主要集中在神经细胞可塑性与神经系统损伤修复、免疫细胞分化与免疫系统疾病、干细胞与再生医学等领域。美国的国立卫生研究院、美国国家科学基金会、德国研究基金会等机构已经启动对“细胞命运可塑性”相关基础研究和应用基础研究项目的重点资助。虽然整体态势处于增速阶段,但是还未有集中和大规模的研究计划或科学规划,资助项目数也不多,相对处于零散和起步阶段。我国如能在现阶段部署“细胞命运可塑性”领域的专项研究,将在战略上抢得先机,并有望凝聚和打造国际领先的创新研究团队,获得多个创新性高、系统性强、国际影响力大的前沿成果,引领生命科学国际学术新方向。
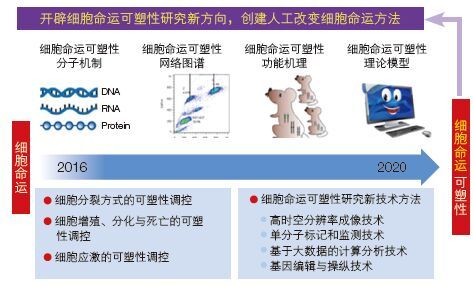
2 拟解决的科学问题,项目布局和承担单位 2.1 拟解决的科学问题本先导专项聚焦“细胞命运可塑性的分子基础与调控”这一生命科学前沿科学问题,以“细胞分裂方式的可塑性调控”“细胞增殖、分化与死亡的可塑性调控”和“应激条件下细胞可塑性调控”作为主要研究方向,同时运用和研发“细胞命运可塑性研究新技术方法”。本专项的实施将系统、全面地解析谁来决定细胞命运、何时何处决定细胞命运、细胞命运维持与转换如何决定及做何决定等一系列重大科学问题;阐释细胞命运维持与转变的分子基础和调控规律,破解细胞生老病死的奥秘,为人工干预细胞命运提供理论依据和模型,开辟“细胞命运可塑性”新方向,丰富理论体系,创新研究范式,引领分子细胞学科发展,形成一支具有国际影响力的杰出研究团队。
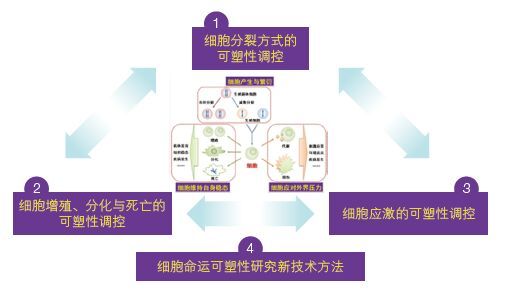
2.2 项目布局本专项聚焦“细胞命运可塑性的分子基础与调控”,以“细胞分裂方式的可塑性调控”“细胞增殖、分化与死亡的可塑性调控”“应激条件下细胞可塑性调控”和“细胞命运可塑性研究新技术方法”作为项目布局(图 1),致力于破解调控细胞增殖、分化与转分化、细胞凋亡与坏死、衰老与病变等关于细胞“生老病死”命运可塑性的奥秘。专项围绕 4 个研究布局形成 4 个项目(图 2)。
|
| 图 1 “细胞命运可塑性的分子基础与调控”先导专项总体布局与项目设置 |
|
| 图 2 “细胞命运可塑性的分子基础与调控”先导专项整体实施路线图 |
(1)项目一:细胞分裂方式的可塑性调控。减数分裂是二倍体细胞变成单倍体配子的分裂方式,其精确完成是确保生殖健康、人口数量与质量的关键。然而,减数分裂是如何启动的?这是生命科学中多年来悬而未决的重要问题。为了回答这一问题,项目将从有丝分裂向减数分裂的转换与减数分裂过程的分子调控两个方向开展研究。
(2)项目二:细胞增殖、分化与死亡的可塑性调控。细胞一旦产生就时刻面临增殖、分化和死亡的抉择。细胞选择分裂为同类细胞、或分化为不同类细胞、或走向病变和死亡,细胞的命运及其可塑性受到细胞内外因素综合和复杂的调控。为了揭示细胞增殖、分化、死亡及其可塑性的调节机理,本项目将从细胞生存方式的可塑性调控与肿瘤细胞的可塑性调控两个方向开展研究。
(3)项目三:应激条件下细胞可塑性调控。在应激条件下如何维持自稳态以及自稳态失衡紊乱后如何恢复稳态是细胞常面临的重大抉择。为了研究在代谢应激、组织细胞损伤或病原微生物感染等条件下,细胞的身份和功能如何发生可塑性变化及其如何决定机体回复稳态或发生病变恶化,本项目将从组织细胞应激的可塑性调控与免疫细胞的可塑性调控两个方向开展研究。
(4)项目四:细胞命运可塑性研究新技术方法。生命科学的迅猛发展离不开分子细胞研究的新技术方法。超分辨率成像、单细胞生物学、系统生物学、合成生物学等是揭示细胞命运可塑性不可或缺的技术平台。本项目将从超分辨率成像与单分子单细胞分析和人工染色体构建与稳定遗传的技术方法两个方向开展研究。
2.3 专项承担单位本专项依托中科院分子细胞科学卓越创新中心/中科院生化与细胞所实施,在中科院统一领导下,通过一体化协同运行,构成分子细胞科学研究的整体布局。在上海、合肥、北京等地,已形成了各具特色但又相互融合、交叉的研究团队,基本建成了以院士牵头,“杰青”“青千”“百人”为骨干的一支极具创新活力的科技生力军,为专项的实施做好了充分的人才储备。生化与细胞所成立于 2000 年 5 月,由原中科院上海生物化学所与原中科院上海细胞生物学所整合而成。生化与细胞所是我国生命科学领域最具科研实力和影响力的国立研究机构之一。经历半个世纪的风雨和几代科学家的艰苦创业和奋斗,研究所(其前身)先后取得了人工合成牛胰岛素、人工全合成酵母丙氨酸转移核糖核酸、卵母细胞的受精成熟和单性生殖、家鱼的人工繁殖等具有重大国际影响的原创性成果,多次获得国家自然科学奖、科技进步奖一等奖。不仅在国内享有崇高的科学和社会声望,也为国际同行所瞩目。生化与细胞所现在具有以分子生物学国家重点实验室、细胞生物学国家重点实验室、国家蛋白质科学研究中心 . 上海(筹)为支撑的三大研究集群,涵盖基因调控、RNA 与表观遗传学,蛋白质科学,细胞信号转导,细胞与干细胞生物学,癌症和其他重大疾病机理五大前沿领域,是专项实施的重要优势基础。过去 5 年间,专项依托及参与单位已在围绕“细胞命运可塑性的分子基础与调控”这一主题的分子细胞科学领域多个研究方向上取得代表性成果,相关研究工作发表在 Science、Nature、Cell 等世界顶尖期刊及其子刊上,3 项研究成果入选年度“中国科学十大进展”。
3 预期成果专项将在“细胞命运可塑性”研究领域取得一批具有开创性、系统性强、国际影响力大的重大前沿成果,力争取得里程碑式的重大科学突破。
(1)细胞分裂方式的可塑性调控。阐明有丝分裂向减数分裂转换的原理;阐释同源染色体交换位点选择的分子基础;揭示减数分裂基因突变的临床意义。阐明单倍体细胞遗传稳定性的维持机制,设计并建立能稳定维持单倍体的单倍体细胞的方案。
(2)细胞增殖、分化与死亡的可塑性调控。发现细胞增殖、分化和死亡的可塑性调控的重要新机理,建立起较为完善的分子调控网络。在肿瘤细胞可塑性的研究方面取得关键发现,为疾病的预防和治疗提供有重要价值的新思路。发现上述细胞命运可塑性调节网络中的关键节点和分子,为人工干预和药物筛选提供靶点。获得具有潜在应用价值的抑制肿瘤细胞增殖和转移、定向诱导或抑制细胞死亡的小分子化合物或抗体。
(3)应激条件下细胞可塑性调控。绘制出系统的代谢调控网络,发现其中关键节点,为改善代谢性疾病提供更加精准的策略。发现调控细胞膜损伤修复等的分子机制并阐明损伤细胞清除和重建的细胞学机理;建立并运用肌肉萎缩等应激动物模型开发新的康复治疗方法。在探讨免疫细胞命运可塑性的机制上取得重大原创性突破,为阻断肿瘤生长、病原微生物感染、自身免疫性疾病探索出新型靶向基因或诊断标志物。
(4)细胞命运可塑性研究新技术方法。建立细胞命运决定蛋白质机器与细骨架组装动力学研究的新技术方法,例如,超高分辨率光学-蛋白质机器活性显微成像技术、信号重塑荧光分子示踪与信号重塑干预化学小分子筛选技术等,推进 2-3 项高时空分辨率显微成像技术的开发。建立细胞分裂命运可塑性相关的在线细胞动力学数据库,建立细胞分裂命运选择与转换机制理论模型,为实验验证提供候选模型与新理论。构建含有简小结构功能单元、稳定遗传的小鼠和人类人工染色体。
(依托单位:中科院上海生命科学院)

