党的“十八大”明确提出我国要“大力推进生态文明建设”,生态文明建设是中国特色社会主义事业的重要内容,关系人民福祉,关涉民族未来,关乎“两个一百年”奋斗目标和中华民族伟大复兴中国梦的实现。生态文明建设的一项重要任务是要提高可持续发展能力,这是合理适度开发利用海岸带资源和综合管控海岸带环境安全的基础和保障。
然而,随着我国沿海开发战略的实施,特别是人工围垦的快速发展,典型的海岸带生境正在或已经遭受严重破坏,海岸带生物多样性与生态系统健康正在承受巨大压力。陆源污染、海水入侵、海岸侵蚀等范围和强度都在不断增大,海岸带生物资源的分布格局已经或者正在发生显著改变,不仅影响农业等传统产业,难以支撑生物工业等战略性新兴产业,同时给生态系统健康带来严峻挑战,影响作为蓝色经济重要支撑的海岸带环境的可持续发展。因此在海岸带高强度人类活动与全球气候变化的背景下,可持续利用能够改善和修复海岸带环境的新型微生物战略资源不仅是重大的科学问题,也是迫切的国家需求。
电微生物(Electricigens)正是这样一类新型的微生物战略资源。该类微生物具有在厌氧条件下进行胞外呼吸的能力,因而能够在有效回收能源(如电能、甲烷和氢气)和资源的同时进行废水处理、环境污染修复等。电微生物学(Electromicrobiology)是以电微生物为研究对象的新兴学科,是麻省大学Amherst分校Derek Lovley教授于2012年在Annual Review of Microbiology上提出的新兴交叉学科名词[1],该学科自诞生的一刻起,就备受全球众多精英科学家们的瞩目,目前正在国际范围内迅猛发展。本文在结合国内外电微生物学研究的基础上,从电微生物学定义、海岸带电微生物学研究与生物资源利用、国内外电微生物学研究发展态势、加强我国海岸带电微生物资源研究与开发的对策建议4个方面阐述国内外电微生物学的研究进展及在海岸带区域开展相关研究的必要性,以促进我国电微生物学的快速发展。
1 电微生物学的定义、内涵及意义“电微生物学”是以电微生物为研究对象的新兴学科,是微生物学与电化学的交叉学科,研究内容涵盖生命科学、化学、地球科学和工程与材料科学,其核心任务是揭示微生物的胞外电子传递机制,探讨其在环境保护、污染治理和新能源开发等可持续发展领域的应用前景。近年来,越来越多的电微生物被发现,涵盖真核微生物和原核微生物,不仅包括细菌,也包括古菌。目前已报道的电微生物大部分都是细菌,分布于变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)。电微生物主要集中在变形菌门的不同亚门,具有不同的产电性能。主要代表菌株为γ-变形菌门的希瓦氏菌(Shewanella sp.)和δ-变形菌门的地杆菌(Geobacter sp.),它们都属于异化铁还原菌[2, 3]。
电微生物的发现促进了微生物燃料电池(Microbial Fuel Cell, MFC)技术和微生物电合成(Microbial Electrosynthesis, ME)技术的产生,从而使产电微生物具有广阔的应用价值和前景。微生物燃料电池技术是以微生物充当催化剂,将化学能转变为电能的技术。产电微生物在阳极室发生产电呼吸,厌氧条件下分解有机物产生二氧化碳,将电子传递到阳极,再经外电路传递给阴极电子受体。该技术不仅可以应用于污染物环境修复[4]、重金属降解[5, 6]、有机废水处理[7, 8]、生物传感器等[9],还能产生电能。微生物电合成技术(图 1), 是基于电微生物学领域新发现开发出来的模拟半人工光合作用的新技术。其基本原理是电微生物通过电极直接获得由太阳能产生的(光)电子,还原二氧化碳产生乙酸、甲酸甚至丁醇等具有高附加值的生物化工或者能源物质等[10-13]。
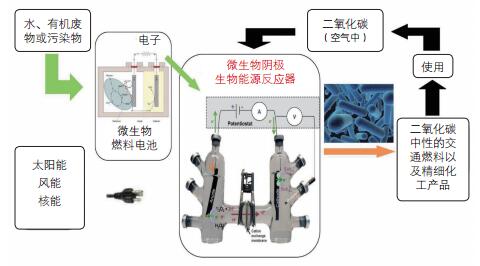
|
| 图 1 微生物电合成技术示意图 |
海岸带是海陆的交接带和过渡带,是复合与交叉的地理单元,具有资源丰富、区位优势明显、生态脆弱、灾害较多的特征。海岸带因陆海两类经济汇聚,生产力内外双向辐射成为社会经济领域中的“黄金地带”,成为人类活动最活跃和最集中的地域。目前,全世界有近60%的人口生活在仅占地球陆地面积10%的海岸带区域。然而,随着人口的大量增加和城市化进程的不断加快,海岸带正面临着全球气候变化、海平面上升、区域生态环境破坏、生物多样性减少、污染加重、渔业资源退化等巨大压力,严重影响了海岸带的可持续发展。海岸带生物资源的可持续发展利用对促进生态文明建设有着非常重要的意义。
传统的微生物资源利用是开发微生物丰富的次生代谢产物,使其在最终解决威胁人类健康的许多重大疾病,如恶性肿瘤、糖尿病、艾滋病等方面具有重要的意义。丹麦奥尔胡思大学的Nielsen团队研究发现,在海洋底泥的厌氧环境中生存的Desulfobulbaceae科新种细菌能够排成一排连接厌氧区和有氧区,让厌氧区的细菌可以抽取硫化氢里的电子传到有氧区交给氧气,从而形成“海底电缆” [14, 15]。这是产电菌在海洋存在的最直接证据,从而使产电微生物作为一种新型的战略资源在海岸带地区具有重要的研究和应用价值。虽然目前有关海岸带区域电微生物的研究还很少,但人们已逐渐认识到电微生物在海岸带地区生物地球化学物质循环、生物能源与环境污染修复、生物膜腐蚀防控等多个方面的重要应用前景。
在物质循环方面,人们认识到滨海生态系统是陆地生态系统的重要延伸,是海岸带区域的重要组成部分,是连接陆地和海洋两大碳库的关键部位。滨海生态系统分布于河口、潮滩及滨海湿地,具有典型的原生性、脆弱性、稀有性,还具有独特的海陆两种属性,是与人类活动相互作用最频繁、最活跃的生态过渡带[16]。滨海河流沿河道进行运动,不仅受沿途地区地貌特征及人为因素等环境的影响,同时也受到海洋及陆海相互作用的影响。滨海河流及其沉积物具备好氧区、厌氧区及好氧-厌氧交替区域,因而发生微生物参与的氧化还原过程极为频繁。滨海河流中微生物组成相应的功能菌群,如氧呼吸菌、硝酸盐还原菌、硫酸盐还原菌、产甲烷古菌、氨氧化菌、铁还原菌等,利用多种电子受体(O2、NO3-、Fe(Ⅲ)、SO42-和CO2)进行呼吸作用,同时在污染物的降解过程中起到重要作用,使滨海河流具有较好的自净和承受污染的能力。滨海湿地由于同时受到陆地和海洋及其相互作用的影响,反复经历淹没-泄水过程,同时具备好氧和厌氧及其有规律交替的环境,因而有关电微生物驱动的碳、铁、硫等生源要素的氧化还原反应及其耦合循环过程中电微生物胞外电子传递机制的研究有重要意义,同时其发生的元素循环在全球气候变化过程中起着举足轻重的作用。
海底沉积物微生物燃料电池是电微生物在海洋及海岸带地区的重要应用体现。将阳极埋在海底沉积物中,阴极放置于接近沉积物的上覆海水中,海底沉积物中丰富的有机质作为电池燃料,海水中的溶解氧作为氧化剂,加之海底沉积物中的微生物在电流输出中起生物催化作用[17-19],再通过外电路连接阴阳两极构建电池装置可以获得低水平的电能。但由于这种海底沉积物微生物燃料电池具有免维护、连续供应、底物丰富、内阻低、环境友好和价格低廉等优点,因而有望作为一种能源装置用于海域工作的低功率温度、盐度、湿度等环境监测仪器。虽然目前还未实现应用,但受到越来越多的关注。根据海底沉积物微生物燃料电池原理,人们构建了各种底泥、活性污泥等微生物燃料电池,在产生电能的同时,降解有机污染物起到环境污染修复作用。
在生物膜研究方面,人们通常认为浸入海水中的海洋人工设施表面由于微生物附着形成的生物膜给海洋人工设施等带来污损、腐蚀等严重危害,造成巨大的经济损失。但电活性生物膜,即生物膜能够接收电子或产生电子的发现使人们认识到,若能充分利用电活性生物膜则其积极的影响要远大于消极作用,并且目前大部分电活性细菌都来源于海水、海洋环境以及废水中[20]。Mansfeld和Nagiub [21]首次提出“使用再生生物膜进行腐蚀控制的概念和理论”,即使用再生细菌控制腐蚀。某些细菌的存在会在金属表面形成生物膜,其产生的代谢物可能是腐蚀抑制剂,使金属表面腐蚀电位变为抑制腐蚀,从而使电活性生物膜在海洋腐蚀防控方面具有巨大的应用前景。
海岸带的电微生物其他应用方面还包括土壤或地下水污染原位修复,以海洋底泥微生物原料电池方式进行海洋石油污染降解、探究海洋生物地球化学过程等。由此可见,MFC研究在越来越多的方向上具有不可低估的作用,电微生物作为一种独特的海岸带战略生物资源具有广阔的应用前景。
3 国内外电微生物学研究发展态势为了进一步了解电微生物学研究的发展态势,文章基于Web of Science数据库进行了检索分析(图 2)。由图可见,自1987年第一株具有胞外电子传递能力的电微生物Geobacter metallireducens在Nature杂志上被报道以来,该领域论文发表数量稳步上升。尤其在1987— 2006年的20年积累基础之上,2007—2011的5年,论文数量呈现加速增长的态势,且在随后5年继续快速增加,该数据是近10年来电微生物学相关领域迅猛发展的有力证明。
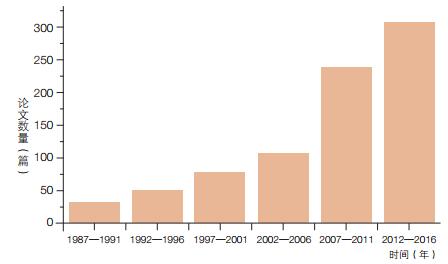
|
| 图 2 电微生物学领域论文数量随着年份的变化情况 |
为了解这些搜索到的论文中出版物种类的分布情况,对其进行了进一步分析。结果显示,其中有大量论文是发表在最有影响力的顶级学术期刊上(图 3),如Nature 11篇,Science 10篇,PNAS 17篇,Nature子刊20篇,除此以外,还有数十篇量级的文章是发表在顶级专业期刊上,如Energy & Environmental Science (33)、ISME Journal (22)、Environmental Microbiology (24)和Applied and Environmental Microbiology (86)。由此可见,电微生物学领域的研究是炙手可热的研究热点,已经受到全世界科学家的广泛关注和重视。
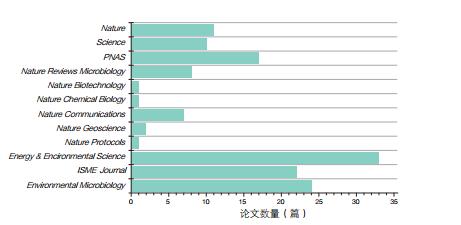
|
| 图 3 电微生物领域论文在顶级学术期刊中的分布 |
为了揭示我国对电微生物学发展的贡献,本文对上述论文按照不同国家进行了统计(图 4)。从各个国家发表的论文数量来看,美国占据绝对优势。我国在被调查的12个科研实力较强的国家中位居次席,说明我国已经具有一定的研究实力,但与美国差距较大,论文数量不及美国的一半。
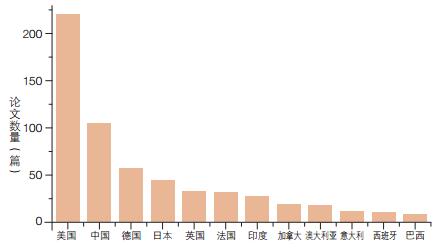
|
| 图 4 不同国家在电微生物领域论文数量比较 |
我国海域辽阔,从南到北跨越热带、亚热带和温带3个气候带,海岸线全长超过32 000公里,其中大陆岸线长超过1.8万公里,邻接大陆的渤海、黄海、东海、南海水域面积达470多万平方公里,沿岸入海的河流主要有鸭绿江、辽河、海河、黄河、淮河、长江、钱塘江、闽江、珠江等江河[22]。我国复杂宽阔的大陆架、丰富的海岸带地貌使海岸带区域成为海洋生物资源较为丰富的地区之一,也是人类生存和经济发展的重要场所,特殊的环境也为电微生物资源的开发提供了良好的基地。
2016年新年伊始,Science上的评述文章就以“ A new diet for methane oxidizers”为题[23],对发表的两篇Nature和一篇Science上的最新研究成果进行了点评,相关工作预示着近40年来的一个谜团即将被解开。评述指出,厌氧甲烷氧化菌被发现与硫酸盐还原菌耦联在一起形成团聚体,却一直未能实现纯培养,其根本原因很可能是需要进行种间直接电子传递。基于这一重要发现,Scheller等人[24]利用稳定同位素示踪等技术证实利用人工电子受体可以解除这种存续至今的耦联关系,从而得到纯培养,这是微生物种间直接电子传递理论又一重要的应用价值体现。而海岸带环境很可能会成为深入开展相关前沿科学研究的重要阵地。
电微生物的胞外呼吸可能是早期地球上微生物的主要代谢方式。胞外电子传递机制是微生物-有机质-矿物相互作用的核心科学问题。迄今为止已发现胞外电子传递机制主要有电子穿梭体机制、纳米导线机制、外膜结合氧化还原蛋白介导机制等[25-30]。滨海湿地理论上是研究微生物胞外电子传递的“黄金区域”。然而,基于海岸带或者滨海湿地原位微生物胞外电子传递的相关研究仍非常少见。因此,在海岸带区域开展微生物胞外电子传递的研究已显得迫在眉睫,相关研究与发展可为我国生态环境的可持续发展提供理论基础和技术途径。
建议充分发挥专项及国家基金委“优秀青年”和“杰出青年”等基金项目的作用,加强青年人才的梯队建设,加强电微生物资源库的建设,加强生物地球化学循环的数据库建设和定量化模型研究,加强复合型人才的培养及国际合作,在应用层面加强与政府和企业的合作,在基础研究层面部署重点研究项目,组织国家/国际层面的大型科学研究计划,甚至建设以“海岸科学”为核心的多学科交叉研究中心。加强电微生物学的研究,有助于利用新型微生物战略资源,有助于我国海岸带经济的可持续发展,有助于生态文明建设。
| [1] | Lovley D R. Electromicrobiology. Annu. Rev. Microbio , 2012, 66 : 391–409. DOI:10.1146/annurev-micro-092611-150104 |
| [2] | Pham C A, Jung S J, Phung N T, et al. A novel electrochemically active and Fe (Ⅲ)-reducing bacterium phylogenetically related to Aeromonas hydrophila isolated from a microbial fuel cell. FEMS Microbiol. Lett , 2003, 223 (1) : 129–134. DOI:10.1016/S0378-1097(03)00354-9 |
| [3] | Kim H J, Park H S, Hyun M S, et al. Amediator-lessmicrobial fuel cell using a metal reducing bacterium, Shewanella putrefaciens. Enzyme Microb. Tech , 2002, 30 (2) : 145–152. DOI:10.1016/S0141-0229(01)00478-1 |
| [4] | Rabaey K, Angenent L, Schröder U, et al.王爱杰等, 译.生物电化学系统:从胞外电子传递到生物技术应用.北京:科学出版社, 2012. |
| [5] | Gregory K B, Lovley D R. Remediation and recovery of uranium from contaminated subsurface environments with electrodes. Environ. Sci. Technol. , 2005, 39 (22) : 8943–8947. DOI:10.1021/es050457e |
| [6] | Wang G, Huang L, Zhang Y. Cathodic reduction of hexavalent chromium Cr (VI) coupled with electricity generation in microbial fuel cells. Biotechnol. Lett. , 2008, 30 (11) : 1959–1966. DOI:10.1007/s10529-008-9792-4 |
| [7] | Zhu X, Logan B E. Using single-chamber microbial fuel cells as renewable power sources of electro-fenton reactors for organic pollutant treatment. J. Hazard Mater , 2013, 252-253 (4) : 198–203. |
| [8] | Mansoorian H J, Mahvi A H, Jafari A J, et al. Bioelectricity generation using two chamber microbial fuel cell treating wastewater from food processing. Enzyme Microb. Tech , 2013, 52 (6-7) : 352–357. DOI:10.1016/j.enzmictec.2013.03.004 |
| [9] | Shen Y, Wang M, Chang I S, et al. Effect of shear rate on the response of microbial fuel cell toxicity sensor to Cu (Ⅱ). Bioresource Technol , 2013, 136 (5) : 707–710. |
| [10] | Logen B E.冯玉杰等, 译.微生物燃料电池.北京:化学工业出版社, 2009. http://www.oalib.com/references/18361254 |
| [11] | Heidrich E S, Dolfing J, Scott K, et al. Production of hydrogen from domestic wastewater in a pilot-scale microbial electrolysis cell. Appl. Microbiol. Biot , 2013, 97 (15) : 6979–6989. DOI:10.1007/s00253-012-4456-7 |
| [12] | Gouveia L, Neves C, Sebastiäo D, et al. Effect of light on the production of bioelectricity and added-value microalgae biomass in a photosynthetic alga microbial fuel cell. Bioresource Technol. , 2014, 154 (2) : 171–177. |
| [13] | Lee D J, Chang J S, Lai J Y. Microalgae-microbial fuel cell:A mini review. Bioresource Technol. , 2015, 198 : 891–895. DOI:10.1016/j.biortech.2015.09.061 |
| [14] | Nielsen L P, Risgaard-Petersen N, Fossing H, et al. Electric currents couple spatially separated biogeochemical processes in marine sediment. Nature , 2010, 463 (7284) : 1071–1074. DOI:10.1038/nature08790 |
| [15] | Pfeffer C, Larsen S, Song J, et al. Filamentous bacteria transport electrons over centimeter distances. Nature , 2012, 491 (7423) : 218–221. DOI:10.1038/nature11586 |
| [16] | 国家自然科学基金委员会, 中国科学院. 中国学科发展战略-土壤生物学. 北京: 科学出版社, 2016. |
| [17] | Tender L M, Reimers C E, Stecher H A, et al. Harnessing microbially generated power on the seafloor. Nat. Biotechnol , 2002, 20 (8) : 821–825. DOI:10.1038/nbt716 |
| [18] | Bond D R, Holmes D E, Tender L M, et al. Electrode-reducing microorganisms that harvest energy from marine sediments. Science , 2002, 295 : 483–485. DOI:10.1126/science.1066771 |
| [19] | Reimers C E, Girguis P, Stecher H A, et al. Microbial fuel cell energy from an ocean cold seep. Geobiology , 2006, 4 (2) : 123–136. DOI:10.1111/gbi.2006.4.issue-2 |
| [20] | Bergel A, Féron D, Mollica A. Catalysis of oxygen reduction in PEM fuel cell by seawater biofilm. Electrochem. Commun , 2005, 7 (9) : 900–904. DOI:10.1016/j.elecom.2005.06.006 |
| [21] | Mansfeld F, Nagiub A. Evaluation of microbiologically influenced corrosion inhibition (MICI) with EIS and ENA. Electrochim. Acta , 2002, 47 (13-14) : 2319–2333. DOI:10.1016/S0013-4686(02)00082-8 |
| [22] | 宋达泉. 我国海岸带土地、生物资源的开发利用. 自然资源学报 , 1988, 3 (2) : 114–120. |
| [23] | Rotaru A E, Thamdrup B. A new diet for methane oxidizers. Science , 2016, 351 (6274) : 658–658. DOI:10.1126/science.aaf0741 |
| [24] | Scheller S, Yu H, Chadwick G L, et al. Artificial electron acceptors decouple archaeal methane oxidation from sulfate reduction. Science , 2016, 351 (6274) : 703–707. DOI:10.1126/science.aad7154 |
| [25] | Wu Y, Liu T, Li X, et al. Exogenous electron shuttle-mediated extracellular electron transfer of Shewanella putrefaciens 200:Electrochemical parameters and thermodynamics. Environ. Sci. Technol. , 2014, 48 (16) : 9306–9314. DOI:10.1021/es5017312 |
| [26] | Liu F H, Rotaru A E, Shrestha P M, et al. Promoting direct interspecies electron transfer with activated carbon. Energy Environ. Sci , 2012, 5 (10) : 8982–8989. DOI:10.1039/c2ee22459c |
| [27] | Rotaru A E, Shrestha P M, Liu F H, et al. A new model for electron flow during anaerobic digestion:direct interspecies electron transfer to Methanosaeta for the reduction of carbon dioxide to methane. Energy Environ. Sci , 2014, 7 (1) : 408–415. DOI:10.1039/C3EE42189A |
| [28] | Liu F H, Rotaru A E, Shrestha P M, et al. Magnetite compensates for the lack of a pilin-associated c-type cytochrome in extracellular electron exchange. Environ. Microbiol , 2015, 17 (3) : 648–655. DOI:10.1111/emi.2015.17.issue-3 |
| [29] | Summers Z M, Fogarty H E, Leang C, et al. Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria. Science , 2010, 330 : 1413–1415. DOI:10.1126/science.1196526 |
| [30] | Rotaru A E, Shrestha P M, Liu F H, et al. Interspecies electron transfer via hydrogen and formate rather than direct electrical connections in cocultures of Pelobacter carbinolicus and Geobacter sulfurreducens. Appl. Environ. Microb , 2012, 78 (21) : 7645–7651. DOI:10.1128/AEM.01946-12 |


